以下部分内容由AI生成,未经严格审核,可能有误。BioCalculator App内信息均人工整理,并经过严格校验,可下载App查看。
储备溶液配制指南 —— 氯化锰(MnCl₂)
氯化锰(MnCl₂)是一种无机盐,可存在无水、二水合物和四水合物形式。水合物为粉色晶体,易溶于水,形成 Mn2+ 离子的水溶液。
商用可购 0.1 M MnCl₂ 水溶液。
实验目的
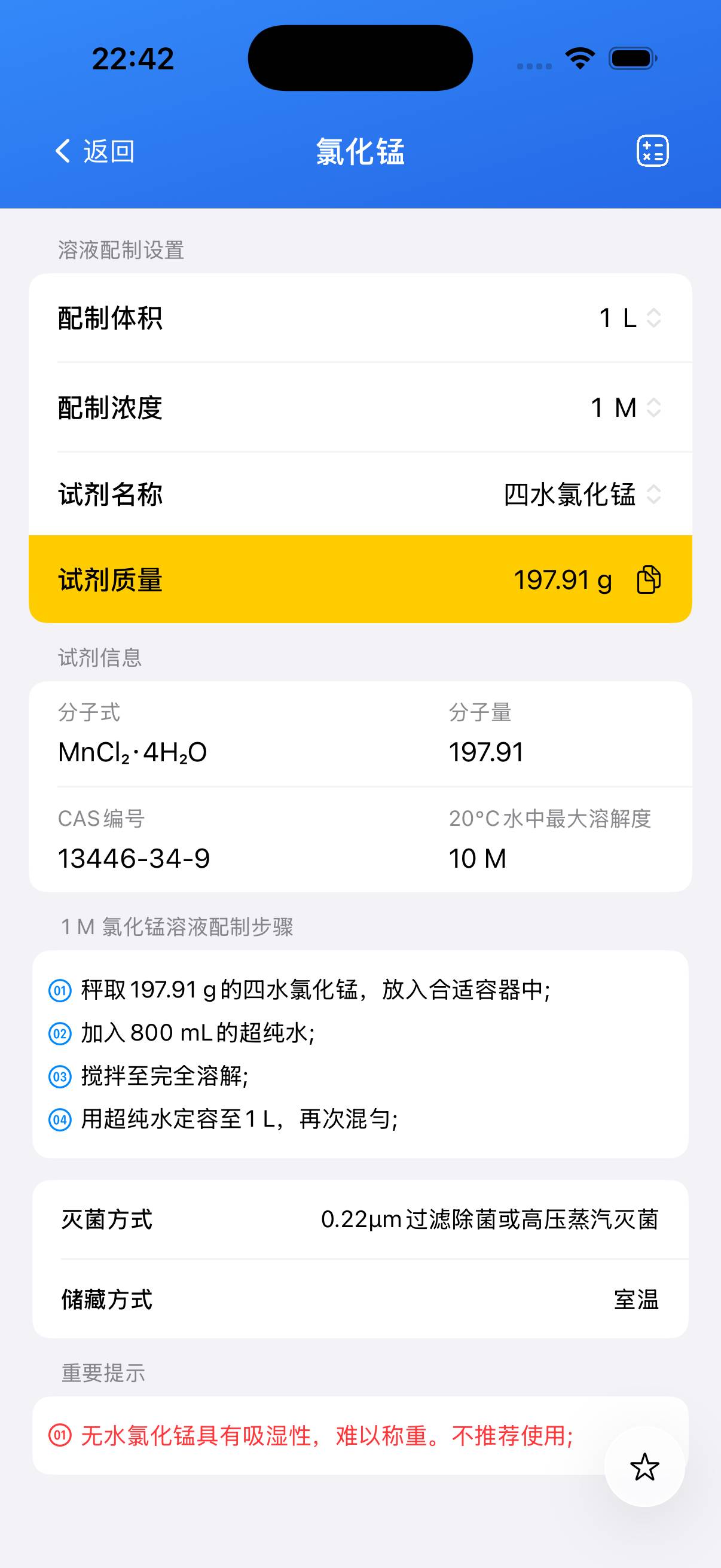
配制 100 mL 0.1 M 氯化锰储备溶液。
溶液组成
- 0.1 M 氯化锰(MnCl₂)水溶液
实验材料
- 氯化锰试剂(无水或水合物)
- 去离子水 / 蒸馏水
- 100 mL 定容瓶或量筒
- 分析天平
- 搅拌工具
- 个人防护装备(手套、护目镜、实验服)
操作步骤
- 步骤 1
计算所需质量:使用无水 MnCl₂(分子量约 125.84 g/mol)配制 0.1 L 0.1 M 溶液:
质量 = 0.1×0.1×125.84 ≈ **1.26 g**。 - 步骤 2
精确称取约 **1.26 g** 无水 MnCl₂。如使用二水合物或四水合物,按其分子量调整。 - 步骤 3
将固体加入约 80 mL 去离子水中搅拌至完全溶解。 - 步骤 4
转移至 100 mL 定容瓶,并用水定容至刻度,充分混匀。
标记溶液浓度与日期,并按实验室规定储存。
可用试剂
| 名称 | 分子式 | 分子量 | CAS |
|---|---|---|---|
| 四水氯化锰 | MnCl₂·4H₂O | 197.91 | 13446-34-9 |
| 二水氯化锰 | MnCl₂·2H₂O | 161.874 | 38639-72-4 |
| 无水氯化锰 | MnCl₂ | 125.844 | 7773-01-5 |
Preview