以下部分內容由AI生成,尚未經過嚴格審核,可能存在錯誤。BioCalculator App內的資訊均由人工整理,並經過嚴格校驗,可下載App查看。
儲備溶液配製指南 —— 氯化錳(MnCl₂)
氯化錳(MnCl₂)是一種無機鹽,可存在無水、二水合物和四水合物形式。水合物為粉紅色晶體,易溶於水,形成 Mn2+ 離子的水溶液。=
商用可購 0.1 M MnCl₂ 水溶液。
實驗目的
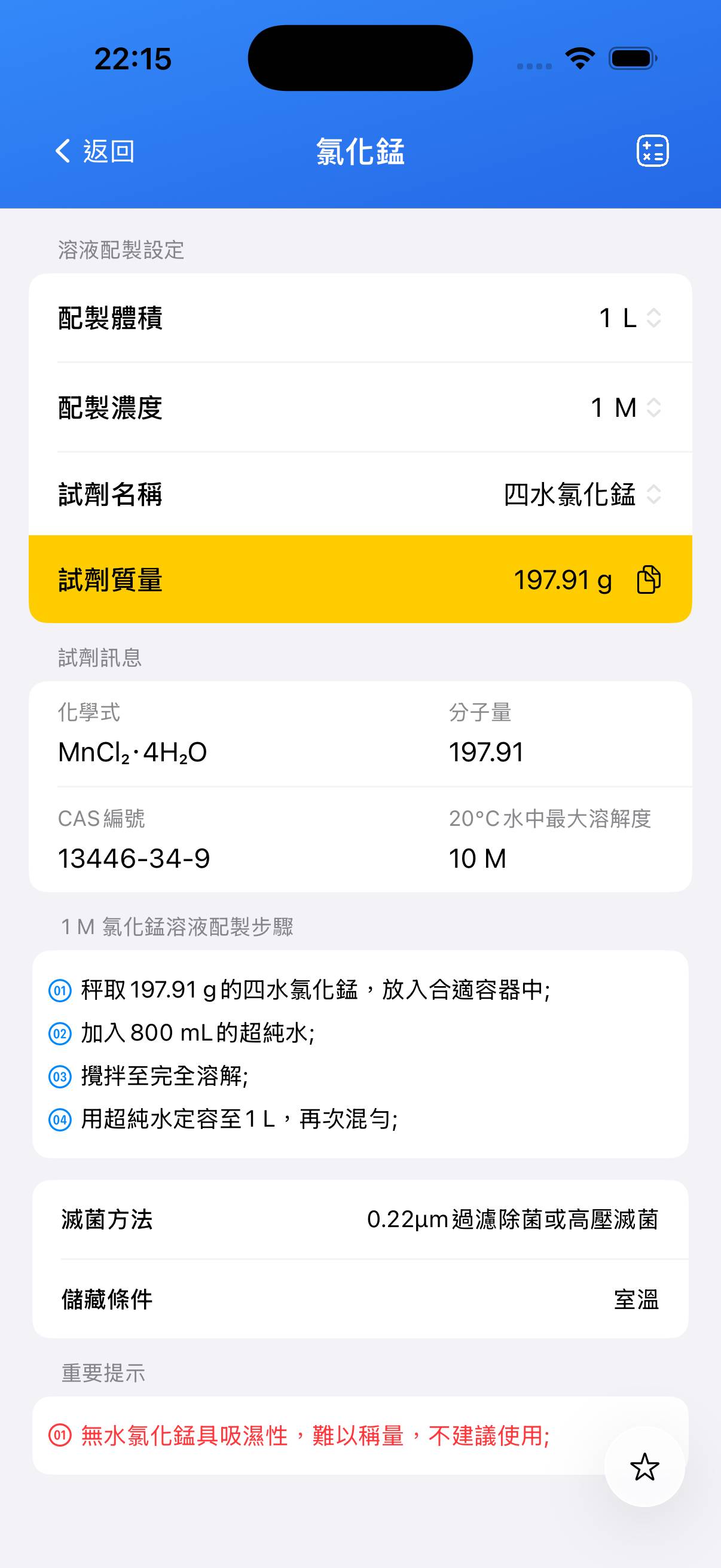
配製 100 mL 0.1 M 氯化錳儲備溶液。
實驗材料
- 氯化錳試劑(無水或水合物)
- 去離子水 / 蒸餾水
- 100 mL 定容瓶或量筒
- 分析天平
- 攪拌工具
- 個人防護裝備
操作步驟
- 步驟 1
計算所需質量:無水 MnCl₂(分子量約 125.84 g/mol)配製 0.1 L 0.1 M 溶液:
質量 ≈ 0.1×0.1×125.84 ≈ **1.26 g**。 - 步驟 2
精確稱取約 **1.26 g** 無水 MnCl₂。如用二水合物或四水合物,按其分子量調整。 - 步驟 3
將固體加入約 80 mL 去離子水中攪拌溶解。 - 步驟 4
轉移至 100 mL 定容瓶,然後定容至刻度,充分混合。
標示溶液濃度與日期,依實驗室規範儲存。
可用試劑
| 名稱 | 分子式 | 分子量 | CAS |
|---|---|---|---|
| 四水氯化錳 | MnCl₂·4H₂O | 197.91 | 13446-34-9 |
| 二水氯化錳 | MnCl₂·2H₂O | 161.874 | 38639-72-4 |
| 無水氯化錳 | MnCl₂ | 125.844 | 7773-01-5 |
Preview